

Artículo de investigación
Evaluación de la funcionalidad de los reportes de los Consejos de Organizaciones Internacionales de las Ciencias Médicas (CIOMS) en comités de ética, en investigación en Ciudad de México*
Evaluation of the functionality of the reports of the Council for International Organizations of Medical Sciences (CIOMS) in ethics committees, in research in Mexico City
Avaliação da funcionalidade dos relatórios dos Conselhos de Organizações Internacionais das Ciências Médicas (CIOMS) em comitês de ética, em pesquisa na Cidade do México
Evaluación de la funcionalidad de los reportes de los Consejos de Organizaciones Internacionales de las Ciencias Médicas (CIOMS) en comités de ética, en investigación en Ciudad de México*
Revista Colombiana de Bioética, vol. 10, núm. 1, 2015
Universidad El Bosque
Recepción: 20 Enero 2015
Aprobación: 09 Junio 2015
Resumen: Los avances científicos y tecnológicos son claves para el desarrollo de nuevos medicamentos y tecnologías. Particularmente en medicina, es necesario generar conocimiento que puede mejorar la probabilidad de éxito. Todo protocolo debe estar autorizado por los comités de ética en investigación, y su seguimiento debe estar especialmente referido a la presentación de efectos adversos o indeseables que deben ser valorados, para garantizar un adecuado riesgo/beneficio al paciente. El instrumento más reconocido en este campo es el reporte del Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS) utilizado mundialmente por la industria farmacéutica. El objetivo general de este estudio consiste en evaluar la funcionalidad del reporte CIOMS en comités de Ciudad de México, mediante un cuestionario validado por expertos y aplicado a una muestra de investigadores y miembros de comités. Los resultados muestran que estos reportes continúan siendo funcionales en un 80,5 %, aunque el 54,5 % de los encuestados sugieren la creación de un nuevo instrumento, con características que no tiene el actual. Sin embargo, se evidencia que los reportes CIOMS siguen siendo eficientes, aunque mejorables.
Palabras clave: Bioética, investigación, comités, ética, evento adverso, CIOMS.
Abstract: Scientific and technological advances are key for the development of new medicines and technologies. Particularly in medicine, it is necessary to generate knowledge that will improve the probability of success. All protocol should be authorized by the ethics research council, and its monitoring should be especially referred to the presentation of adverse and undesirable affects that should be valued, to guarantee an adequate risk/benefit for the patient. The most recognized instrument in this field is the Council for International Organizations of Medical Sciences’ (CIOMS) report used worldwide by the pharmaceutical industry. The general objective of this study consists in evaluating the functionality of the CIOMS report in committees in Mexico City, through a questionnaire validated by experts and applied to a sample of investigators and members of committees. The results show that this reports continue to be functional in some 80.5%, although 54.5% of the surveyed suggest the creation of a new instrument, with characteristics that the current one does not have. Nonetheless, it is evidenced that the CIOMS reports continues to be efficient, although with room for improvement.
Keywords: bioethics, research, committees, ethics, adverse event, CIOMS.
Resumo: Os avanços científicos e tecnológicos são a chave para o desenvolvimento de novos medicamentos e tecnologias. Especialmente na medicina, é necessário gerar conhecimento que possa melhorar a probabilidade de êxito. Todo protocolo deve estar autorizado pelos comitês de ética em pesquisa, e seu monitoramento deve ser referido especialmente à apresentação de efeitos adversos ou indesejáveis, que devem ser valorizados, para garantir um risco/benefício adequado ao paciente. O instrumento mais reconhecido neste campo é o relatório do Conselho de Organizações Internacionais das Ciências Médicas (CIOMS) utilizado mundialmente pela indústria farmacêutica. O objetivo geral deste estudo consiste em avaliar a funcionalidade do relatório CIOMS em comitês da Cidade do México, por meio de um questionário validado por peritos e aplicado a uma amostra de pesquisadores e membros de comitês. Os resultados mostram que estes relatórios continuam sendo funcionais em 80,5%, embora 54,5% dos pesquisados sugiram a criação de um novo instrumento, com características diferentes do atual. No entanto, evidencia-se que os relatórios CIOMS seguem sendo eficientes, embora aperfeiçoáveis.
Palavras-chave: bioética, pesquisa, comitês, ética, evento adverso, CIOMS.
Introducción
Los avances científicos y biotecnológicos, así como la incidencia de factores sociales y jurídicos en el mundo de la salud, han llevado, especialmente a la medicina, a reconsiderar su epistemología y praxis, ya que las expectativas emergentes sobrepasan los objetivos clásicos de la atención médica. Como menciona Casas[1], el modelo unilateral de decisión terapéutica ha sido forzado al cambio por la incidencia de la multidisciplinariedad en las áreas de salud. La economía, la política, el derecho, entre muchos otros campos de conocimiento, presionan las decisiones médicas, las hacen difíciles, y en ocasiones polarizan las acciones de salud. Este avance científico-tecnológico es una de las claves para el desarrollo de fármacos y tecnologías que ayudan a solucionar algunos de los problemas que afectan a la humanidad. La medicina, siguiendo una tradición clásica, conserva como unos de sus objetivos la prevención, curación y rehabilitación, y para ello es necesario generar conocimientos que permitan mejorar las probabilidades de éxito.
Karlberg y Speers[2] refieren que la búsqueda de conocimiento y su aplicación a humanos no está exenta de riesgos, eventos adversos y secundarios, que son inherentes a la actividad orgánica de cualquier droga. No siempre los pacientes son beneficiados al entrar a un protocolo de investigación, pues se reportan numerosas experiencias negativas en el uso de fármacos, tanto antes como después de su comercialización, como lo exponen Buerki[3], Goldacre[4] y Brody[5], lo que ha hecho obligatorio el monitoreo de estos eventos. Véase documento Cofepris[6], y textos de Veach[7] y White[8].
La seguridad de un medicamento, especialmente en su uso en humanos, constituye un asunto de vital importancia, por lo que el reporte de eventos adversos en los ensayos clínicos se considera un eslabón primordial. Una forma estandarizada propuesta para uso internacional han sido los reportes CIOMS, que son auspiciados por la Unesco y la OMS.
Las pautas éticas de investigación en humanos cuentan con un importante antecedente ocurrido después de la Segunda Guerra Mundial como fruto del proceso de Núremberg, cuyos modelos dieron origen a la Declaración de Núremberg[9] y posteriormente a la Declaración de Helsinki[10], actualmente adoptadas por la Asociación Médica Mundial. A fines de la década de los 70, CIOMS en asociación con la OMS, empezó a trabajar en ética de la investigación biomédica, cuyo objetivo, según Bankowski y Howard-Jones[11] se centró en indicar el modo como los principios éticos que debieran guiar la conducta de la investigación biomédica en seres humanos, establecidos por la Declaración de Helsinki, podían ser aplicados en forma efectiva, especialmente en los países en desarrollo, según sus circunstancias socioeconómicas, sus leyes y regulaciones, así como sus disposiciones ejecutivas y administrativas. Los nuevos descubrimientos en la biomedicina, particularmente en el desarrollo de nuevos medicamentos y la experimentación en poblaciones vulnerables que están dentro de ensayos multinacionales, hicieron necesaria la revisión y actualización de las pautas CIOMS[12] que se habían dictado en 1982. El resultado fue la aparición de las Pautas Internacionales para Revisión Ética de Estudios Epidemiológicos, en 1991, y las Pautas Éticas Internacionales para la Investigación Biomédica en Seres Humanos, en 1993.
Los reportes CIOMS fueron aceptados internacionalmente, en especial para su uso en protocolos de investigación en humanos en la industria farmacéutica. Estas pautas internacionales están en constante revisión y actualización, para que así los sujetos de investigación que estén dentro de protocolos estén siempre protegidos y vigilados, como del mismo modo los principios bioéticos y dignidad humana estén siempre respetados.
El último documento revisado, que es el que actualmente se usa, se publicó en el año 2002. Este documento establece principios éticos generales y está destinado a orientar principalmente a los países de bajos recursos en las pautas nacionales sobre ética de la investigación biomédica, así como a establecer y mejorar los mecanismos adecuados para la evaluación ética de la investigación en seres humanos, principalmente evaluación y reporte de eventos adversos y secundarios, teniendo en cuenta el respeto a los principios de autonomía y no maleficencia, para proteger a las personas y poblaciones dependientes o vulnerables.
En México, la regulación está a cargo de la Secretaría de Salud, la Comisión Federal para la protección contra riesgos sanitarios (Cofepris), y la Comisión Nacional de Bioética (Conbioética), que han aceptado el formato CIOMS para reporte de eventos adversos. Los investigadores deben considerar solamente un evento adverso severo (EAS) que en la nomenclatura internacional se le conoce como SUSAR[13], por sus siglas en inglés, que significan «Suspected and Unexpected Serious Adverse Reaction», y cualquier efecto incluido en esta definición deberá ser reportado oportunamente a los comités.
El término unexpected (inesperado; no esperado) significa que para un medicamento ya autorizado (aprobado), ese evento no se describe en el etiquetado del producto, o en el caso de un producto en investigación (no aprobado), que el evento no aparece en la lista descriptiva, tanto del medicamento como demás eventos adversos mencionados en el folleto que el investigador recibe por parte del patrocinador. Este tipo de eventos también están incluidos en reporte obligado a comités, y pueden constituir por su gravedad o frecuencia, una alerta de suspensión del protocolo.
Los comités de ética en Investigación registrados ante Conbioética[14] y Cofepris, aparecen en las guías técnicas, especialmente en Conbioética, como las entidades a cargo de velar por el cumplimiento ético de la investigación, especialmente en lo que se refiere al consentimiento válidamente informado y la evaluación de eventos adversos en los protocolos. En caso de incumplimiento, el comité puede suspender el protocolo. Por otra parte, el investigador principal es el directamente responsable de que el protocolo se realice con los más altos estándares que la ciencia y la ética permita. Es así como los comités (con base en los reportes recibidos del investigador principal y después de su estudio), determinan si la investigación debe proseguir.
Sin embargo, en la práctica esto es sumamente difícil, pues los reportes internacionales no aportan los datos suficientes para ser aplicados en la población local, cuando, en ocasiones, no se ha generado ningún documento, y tampoco tienen contacto con los sujetos de investigación, lo que impide evaluar el riesgo de esa población en particular. Los investigadores generalmente esperan notificaciones oficiales de los patrocinadores, que se generan por estudios estadísticos, muchas veces después de varios meses de haberse generado el evento adverso. Estos factores contribuyen a que el comité no sea competente para evaluar eventos adversos cuando estos son reportes diversos y sin correlación con la población total. Es muy frecuente que se reciban reportes varios, pero ya que el comité desconoce la población total de sujetos en que se está aplicando el medicamento, no puede darse cuenta porcentualmente en qué medida ese evento es frecuente o no.
Como establece la OMS[15], los comités de ética en investigación de hospitales públicos se enfocan, principalmente, en la relevancia de la investigación para los pacientes, y apuntan más a la investigación epidemiológica, mientras que los hospitales privados se enfocan más en la evaluación de eventos adversos, y dirigen la responsabilidad de los protocolos al investigador principal. Si finalmente el investigador principal es el que asume la responsabilidad de continuar o no con la investigación, este puede continuarla a pesar de que un reporte CIOMS esté indicando lo contrario y sin que un Comité de Ética en Investigación (CEI), pueda intervenir. La Secretaría de Salud[16] establece en la Guía Nacional para la integración y el funcionamiento de los Comités de Ética en Investigación que si estos reportes CIOMS no están claramente presentados, las recomendaciones que un CEI pueda llegar a hacer estarán posiblemente sesgadas y, por lo tanto, no se podrán tomar en cuenta. Es por esto que la claridad de los reportes es vital, así como lo es la manera como se tiene que hacer el reporte a las autoridades regulatorias.
Otro brazo de vigilancia, como anteriormente se acotó, lo constituye Cofepris[17] que, con la Comisión Nacional de Farmacovigilancia, ha elaborado una guía que establece los lineamientos generales que se deben seguir para la notificación de eventos adversos, así como los conceptos que se deben usar. Está basada en las modificaciones que se le hicieron a la Norma Oficial Mexicana[18] en cuanto a la Instalación y Operación de la Farmacovigilancia. lOS los lineamientos más importantes contenidos en el marco regulatorio, están señalados cuándo hay que reportar los eventos adversos, el tiempo de ventana para hacerlo, cómo reportarlos y a quién reportar. Se especifica que si es un evento adverso serio (grave), el tiempo de ventana no debe de superar los 15 días, y los eventos adversos leves y moderados quedan con una ventana de 30 días. Estos lineamientos son orientadores en forma, más no en fondo, para evaluar adecuadamente los eventos adversos reportados.
Los reportes CIOMS son un elemento muy importante en el seguimiento de eventos adversos y, por ello, su operatividad debe ser estudiada, para que este importante punto sea cumplido con la mayor eficiencia.
1. METODOLOGÍA
Estudio piloto, mixto, con encuesta transversal y observacional, con preguntas mixtas, abiertas y cerradas, codificadas de forma dicotómica, semiestructurada, en muestra no representativa por saturación de respuestas o 22 encuestas con técnica de cadena, con caso cero determinado por expertos. La composición de la muestra fue de 22 encuestados, de los cuales, 13 pertenecen a comités privados y 9 a comités públicos, 6 de ellos son miembros de un CEI (médicos, enfermeras, abogados), y 16 son investigadores clínicos. Participaron en el estudio 53.8 % de los CEI privados y un 55.6 % de los CEI públicos. Se consideró esta muestra balanceada para este parámetro.
El enfoque de la interpretación de resultados fue de tipo cualitativo y se usó el razonamiento inductivo. La técnica de recopilación de información que se utilizó fue una encuesta validada por expertos que consta de 10 preguntas y se aplicó a miembros de CEI, en humanos y/o investigadores, que han estado en contacto y usado estos reportes.
Se obtuvo una muestra por conveniencia de 22 individuos (miembros y/o investigadores), pertenecientes a cualquiera de los 66 CEI del Distrito Federal. El plan de análisis de la información se dividió en tres etapas. La primera fue el análisis de fase cualitativa, mediante la codificación y categorización de las respuestas abiertas de las preguntas relacionadas con las ventajas y desventajas de los reportes CIOMS y las principales características de un nuevo instrumento. La segunda fase cuantitativa se describió, mediante la distribución de frecuencias absolutas y relativas para cada una de las preguntas categóricas. En la tercera fase, se probaron asociaciones entre las variables. Su significado estadístico se estimó mediante una prueba Chi cuadrada de Pearson que tomó como significativo un valor de p< 0.05.
2. RESULTADOS
Se encuestaron 22 individuos pertenecientes a Comités de Ética en Investigación (CEI) de la Ciudad de México, de los cuales 13 pertenecen a comités privados y 9 a comités públicos; en 6 de ellos sus miembros son únicamente médicos, enfermeras y abogados, y 16 son investigadores clínicos, también pertenecientes a CEI.
Encuesta realizada a expertos en investigación clínica con humanos:
Encuesta #____
Encuesta a expertos en investigación con humanos, acerca de la funcionalidad de los reportes CIOMS en la evaluación de eventos adversos
La presente entrevista será confidencial y anónima. Los entrevistados serán referenciados con número consecutivo, los datos obtenidos serán utilizados para difusión científica.
1 2 3 4 5
6 7 8 9 10
________________________________.
________________________________.
________________________________.
________________________________.
________________________________.
________________________________.
SÍ _______ NO______
Debe depender solamente de la decisión del CEI _____________________.
Debe considerase entre el CEI y el investigador principal ______________.
Debe depender únicamente del investigador principal _________________.
SÍ _______ NO_______
SÍ _______ NO________
SÍ _______ NO________
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
_____________________________.
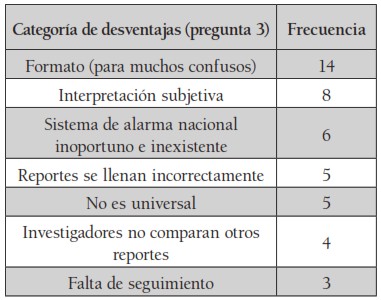
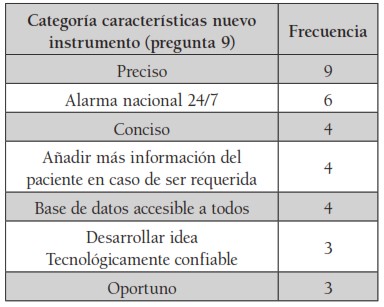
Con respecto a las preguntas abiertas (preguntas 2, 3 y 9), se obtuvieron categorías conceptuales que se ordenaron según la relevancia y frecuencia obtenida en las encuestas. Las tablas 1, 2 y 3 muestran las categorías más relevantes que se obtuvieron en las preguntas abiertas.
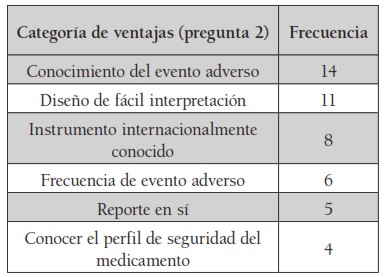
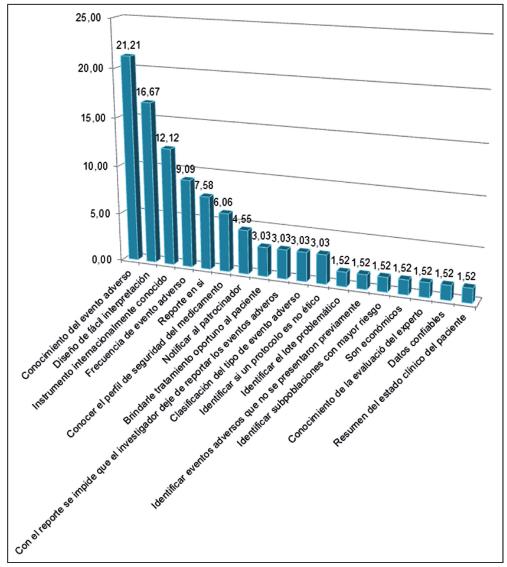
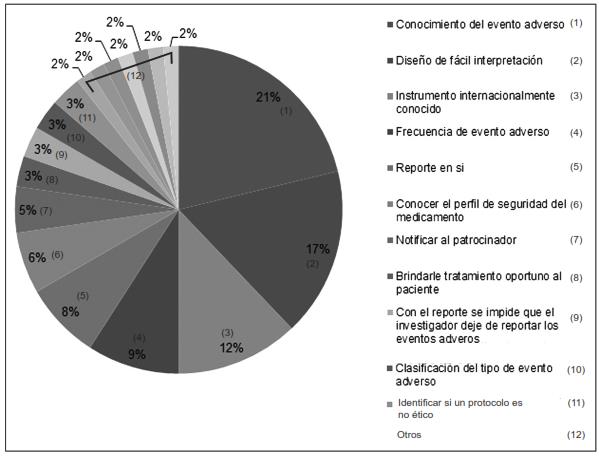
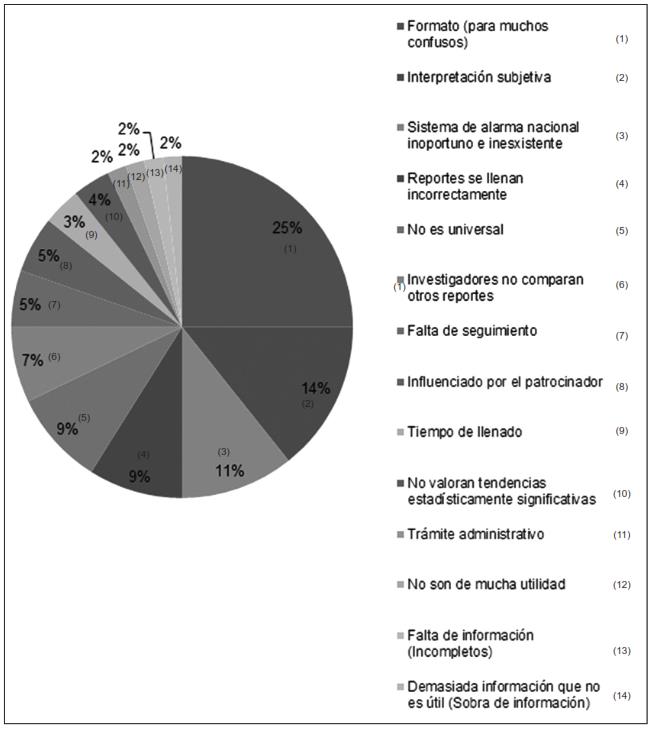
Con respecto al porcentaje de dichas preguntas abiertas, las figuras 1, 2 y 3 muestran los resultados porcentuales de las frecuencias obtenidas en cada una de ellas (preguntas 2, 3 y 9). Se observa que de los porcentajes de ventajas de los reportes CIOMS consideradas por los encuestados, se encuentran con mayor relevancia las siguientes: el 21.2 % corresponde al hecho mismo del conocimiento del evento adverso; el 16.6 % a que cuenta con un diseño de fácil interpretación; el 12.1 % que es un instrumento internacionalmente conocido, y con el 9 % la frecuencia de repetición del evento adverso.
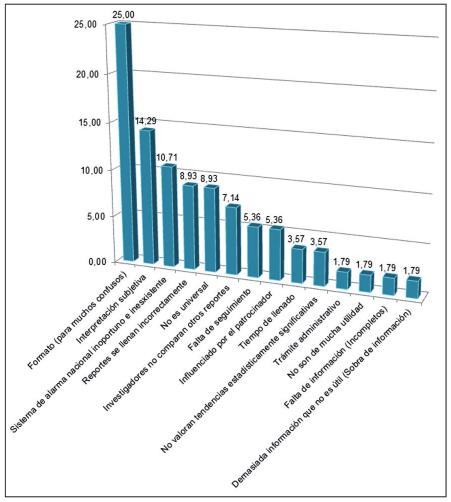
De los porcentajes de desventajas de los reportes CIOMS, los más relevantes mencionados por los encuestados son los siguientes: el 25 % de los encuestados refiere que el formato en sí es una desventaja, ya que para muchos suele resultar confuso; el 14.2 % refiere que el problema es la interpretación subjetiva que se le da a los reportes; el 10.7 % refiere como desventaja un sistema de alarma nacional inoportuno o inexistente, y, finalmente, el 8.9 % menciona que la mayoría de las veces el llenado de los reportes se hace incorrectamente.
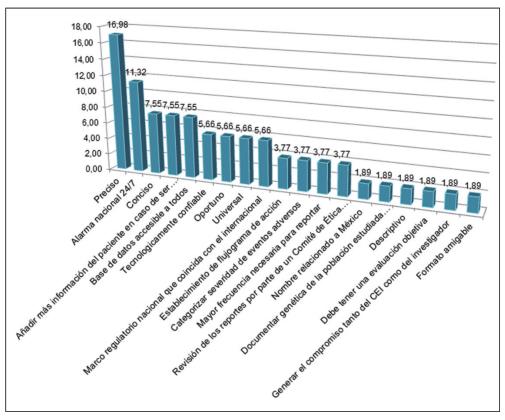
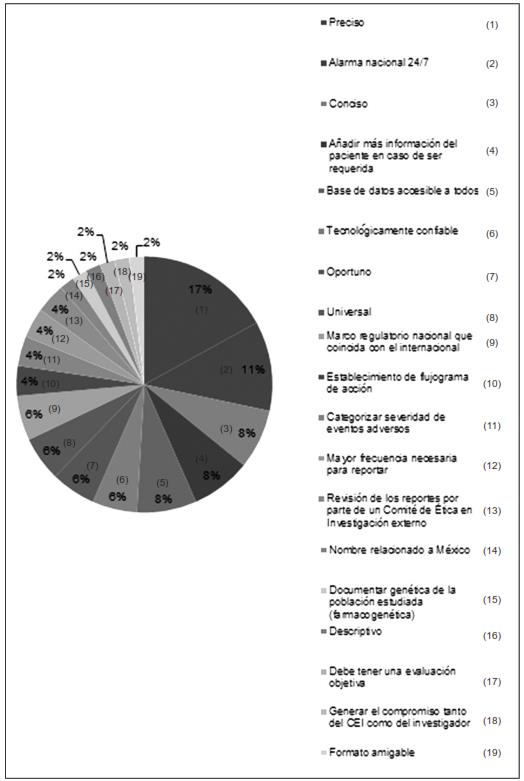
De los porcentajes de características con las que debería de contar un nuevo instrumento de reporte de eventos adversos, las más relevantes fueron: 16.9 % de los encuestados creen que debería ser más preciso; el 11.3 % que debería existir un sistema de alarma nacional que funcione las 24 horas del día los 7 días de la semana; el 7.5 % que fueran más concisos; 7.5% que cuenten con más información clínica del paciente para casos en los que fuera requerida, y, finalmente, que exista una base de datos nacional e internacional fácilmente accesible y para todos en un 7.5 %.
3. DISCUSIÓN Y CONCLUSIONES
Una de las principales funciones de los Comités de Ética en Investigación (CEI) es la evaluación de riesgo/beneficio de los protocolos de investigación realizados en humanos. El reporte de eventos adversos es crucial para esta evaluación y el reporte CIOMS es utilizado en países en desarrollo, como lo es México, como forma de reporte oficial de la mayoría de las empresas farmacéuticas.
Como se observa en International Ethical Guidelines for Biomedical Research Involving Human Subjects de CIOMS[19], la última revisión, tanto de las guías éticas como de los reportes en la materia, tienen poco más de 10 años y, debido a que la mayoría de los miembros de los CEI no tienen el entrenamiento necesario para el uso de este instrumento, resulta fundamental realizar una evaluación de la efectividad de su uso en la población mexicana.
Uno de los resultados significativos consistió en que el 37.5 % de los investigadores y el 66.7 % de los miembros de comités se encuentran conformes con el uso de los reportes CIOMS, resultado que hace cumplir el objetivo principal de este estudio. Respecto del criterio de suspensión de un protocolo con base en reporte de efectos adversos, tanto comités públicos como privados consideran que no puede realizarse en forma unilateral por el CEI (pregunta 5.1), reportándolo así el 75 % de los CEI privados y el 85.7 % de los CEI públicos.
Llama la atención que 92.9 % de los investigadores y 100 % de los miembros de los CEI, consideran que tampoco la suspensión del protocolo debe ser decisión unilateral por parte del investigador, lo cual contradice la Declaración de Helsinki, lo que denota una pobre información de los investigadores y miembros de comités (pregunta 5.3), pues acorde con la Declaracion de Helsinki, es precisamente el criterio del investigador o del comité respecto a si consideran peligroso para los pacientes continuar el protocolo, la causa de su suspensión, aun en forma unilateral. El estudio demuestra que tanto para miembros de CEI públicos como privados y para investigadores, la decisión de suspensión del protocolo debe ser conjunta entre investigador y CEI (pregunta 5.2). En este sentido respondieron el 75 % de los CEI privados y el 88.9 % de los CEI públicos, así como el 75 % de los investigadores. Esta resolución conjunta es ideal, pero no necesariamente realista. Como se señaló anteriormente, la decisión de suspender un protocolo es de la parte que con bases realistas considere peligroso que los pacientes continúen en el estudio.
Sobre el objetivo de este trabajo, acerca de si los reportes CIOMS son funcionales en la evaluación de efectos adversos y suspensión de protocolo, solamente el 50 % de los miembros y el 56.3 % de los investigadores consideran que la suspensión de un protocolo de investigación sí debe basarse únicamente en los reportes CIOMS (pregunta 4). Sobre la posibilidad de utilizar un nuevo instrumento para reporte de efectos adversos que tuviera mejor efectividad que el CIOMS en la evaluación, el 62.5 % de los investigadores (pregunta 8) responde en forma afirmativa, mientras que el 66.7 % de los miembros de los CEI no consideran adecuado un nuevo instrumento diferente del CIOMS.
Respecto de las características de mejora o propuestas para la elaboración de un documento de detección de eventos adversos más funcional, los encuestados respondieron así: 16.9 % propuso que sea más preciso; 11.3 % propuso que exista una alarma nacional que opere diariamente (incluidos los fines de semana); el 7.5 % cree que los reportes deberían incluir más información clínica del paciente, y el mismo porcentaje (7.5 %) cree que sería de gran utilidad la creación de una base de datos nacional e internacional, accesible para todos los investigadores.
Uno de los puntos más importantes y discutidos durante las reuniones nacionales de comisiones estatales en bioética[20], fue el hecho de que la mayoría de los miembros de los CEI no tienen una capacitación adecuada; por este motivo, la Comisión Nacional de Bioética de México, hace un constante esfuerzo para capacitar a sus miembros. De esta forma, los informes CIOMS podrán ser más claros en su redacción e información, como es solicitado por los investigadores, lo cual será un punto favorable para la actualización de este instrumento y así seguir siendo de utilidad para la comunidad en países en desarrollo.
La Ley General de Salud[21] establece que tanto los médicos como los miembros de un Comité de Ética deben recibir capacitación constante y educación bioética permanente. Esto indica que en esta capacitación constante debería incluirse capacitación en la adecuada interpretación de estos reportes, su actualización o configuración de un nuevo instrumento que cubra las necesidades expresadas por los investigadores.
La necesidad de un instrumento sencillo y práctico para reporte efectos adversos, especialmente en protocolos multicéntricos de farmacéuticas, es un aspecto esencial para llevar a cabo la protección del paciente y la calidad de la investigación. En este estudio piloto se aprecia la necesidad de revisión de este importante instrumento en la investigación en humanos en países en desarrollo.
Bibliografía
BANKOWSKI, Z. y HOWARD-JONES, N. (Edit). Human Experimentation and Medical Ethics. Proceedings of the XVth CIOMS Round Table Conference, Manila, 13-16 September 1981. Geneva: Council for International Organizations of Medical Sciences. 1982.
BRODY, Howard. Hooked: Ethics, the Medical Profesion, and the Pharmaceutical Industry. Lanham (MD): Rowman & Littlefield Plublishers, 2011.
BUERKI, Robert y VOTTERO, Louis. Pharmacy Ethics: A Foundation for Professional Practice. Washington: American Pharmacists Association, 2013.
CASAS M., María De la Luz. Bases bioéticas en la toma de decisión. México: Trillas, 2008.
CIOMS. International Ethical Guidelines for Biomedical Research Involving Human Subjects. [En línea]. [Fecha de consulta 15 de abril de 2013]. Disponible en https://cioms.ch/shop/product/international-ethical-guidelines-for-biomedical-research-involving-human-subjects-2/
CÓDIGO DE NÚREMBERG. [PDF]. [Fecha de consulta 15 de enero de 2014], Disponible en http://www.conbioetica-mexico.salud.gob.mx/descargas/pdf/normatividad/normatinternacional/2.INTL._Cod_Nuremberg.pdf
COFEPRIS. Comisión Federal para la protección contra riesgos sanitarios. México, D. F. [En línea]. [Fecha de consulta 15 de enero de 2014]. Disponible en https://www.gob.mx/cofepris
COFEPRIS. Guía de Farmacovigilancia para el Reporte de Eventos Adversos en Investigación Clínica. México D.F. [PDF]. [Fecha de consulta 20 de mayo 2013]. Disponible en https://www.gob.mx/cofepris/documentos/guias-lineamientos-y-requerimientos-de-farmacovigilancia
CONBIOÉTICA. Reuniones Nacionales. [En línea]. [Fecha de consulta 20 de noviembre de 2014]. Disponible en http://www.conbioetica-mexico.salud.gob.mx/interior/perfiles_ceb/reunionesnacionales2.html
DECLARACIÓN DE HELSINKI DE LA ASOCIACIÓN MÉDICA MUNDIAL. [PDF]. [Fecha de consulta 15 de enero de 2014]. Disponible enhttps://www.wma.net/es/30publications/10policies/b3/17c_%20es.pdf
GOLDACRE, Ben. Bad Pharma: How Drug Companies Mislead Doctors and Harm Patients. London: HarperCollins, 2013.
KARLBERG, Johan y SPEERS, Marjorie A. (Edits). Revisión de ensayos clínicos: una guía para el Comité de ética. Hong Kong: Universidad de Hong Kong, 2010, p. 59. [PDF] [Fecha de consulta 12 de noviembre de 2014]. Disponible en http://www.pfizer.com/files/research/research_clinical_trials/ethics_committee_guide_spanish.pdf
MÉXICO. CONGRESO GENERAL DE LOS ESTADOS MEXICANOS. Ley General de Salud. Artículo 41 Bis. Diario Oficial de la Federación. [En línea]. [Fecha de consulta 13 de mayo de 2013]. Disponible en http://dof.gob.mx/nota_detalle.php?codigo=5224260&fecha=14/12/2011
MÉXICO. SECRETARÍA DE SALUD Guía nacional para la integración y el funcionamiento de los Comités de Ética en Investigación. [PDF]. [Fecha de consulta 4 de abril de 2014]. Disponible en http://www.conbioetica-mexico.salud.gob.mx/descargas/pdf/registrocomites/Guia_CEI.pdf
MÉXICO. Norma Oficial Mexicana NOM-220SSA1-2002. Instalación y operación de la farmacovigilancia. [En línea]. [Fecha de consulta 20 de mayo de 2013]. Disponible en http://www.salud.gob.mx/unidades/cdi/nom/220ssa102.html
NHS. HEALTH RESEARCH AUTHORITY. SUSAR. [En línea]. [Fecha de consulta 13 de mayo de 2013]. Disponible en http://www.hra.nhs.uk/news/dictionary/susar/
OMS. Operational Guidelines for ethical committees that review biomedical research. [PDF]. [Fecha de consulta 24 de agosto de 2013]. Disponible en http://www.who.int/tdr/publications/documents/ethics.pdf
VEATCH, Robert y HADDAD, Amy. (Edit). Case Studies in Pharmacy Ethics. New York: Oxford University Press, 1999.
WHITE, Bruce. Drugs, ethics and quality of life. Abigdon: Taylor & Francis, 2007.
APÉNDICES
Notas
Notas de autor
Enlace alternativo
https://revistas.unbosque.edu.co/index.php/RCB/article/view/680/258 (pdf)