Tuberculosis multidrogorresistente
Multidrug-resistant tuberculosis
Artículo de revisión
Recibido: 05/11/2019
Aprobado: 14/04/2020
Publicado: 15/06/2020
Autores
José Augusto Urrego-Díaz
Resumen
La tuberculosis (TB) es la enfermedad bacteriana infecciosa que más muertes causa en el mundo, panorama que puede empeorar debido a la drogorresistencia. La tuberculosis multidrogoresistente (TB-MDR), es decir la que presenta resistencia simultánea a isoniazida y rifampicina (principales fármacos antituberculosos), tiene una relevancia particular: de los 10 millones de personas que desarrollan TB anualmente, 458.000 presentan TB-MDR con un pronóstico mucho peor que el de los infectados por cepas sensibles. En el presente artículo se exploran los principales aspectos de la TB-MDR, haciendo énfasis en su tratamiento.
Abstract
Tuberculosis (TB) is the worldwide leading infectious cause of death and, the emergence of drug-resistant tuberculosis can only worsen the scenario. Multidrug-Resistant Tuberculosis (TB-MDR) has proven resistant to both isoniazid and rifampin, the main antituberculous drugs. Out of 10 million people developing TB annually, 458 000 exhibit TB-MDR, having worse prognosis than those infected by sensitive strains. Recently, new drug-resistant TB treatment guidelines were issued both by the World Health Organization and health authorities in Colombia. The present paper explores the main aspects of TB-MDR emphasizing s sanitary authorities also, new guidelines were published by Colombian minister of health and social protection. In this paper, the main aspects of TB-MDR are explored, especially those related to its treatment.
Introducción
La tuberculosis (TB) es una enfermedad producida por Mycobacterium tuberculosis, una bacteria aerobia, inmóvil, intracelular y de crecimiento lento que se transmite por vía respiratoria (1,2). La respuesta inmune inefectiva es la causante de esta patología, pues no se conoce ninguna toxina o enzima micobacteriana que produzca destrucción tisular (1,2). Si bien hasta el 86% de las veces el compromiso es pulmonar, con una mayor frecuencia de infección extrapulmonar en coinfección por VIH, cualquier órgano del cuerpo puede verse afectado por esta enfermedad (3,4).
La TB es uno de los principales problemas para la salud pública en el mundo (5), pues se estima que cerca de un cuarto de la población mundial presenta la infección (6) y que alrededor de 10 millones de personas desarrollan la enfermedad anualmente (3). La TB produce la muerte de alrededor de 1,2 millones de personas al año, lo que la convierte en la principal causa de muerte por un único agente infeccioso en el mundo (3). En el caso de Colombia, la Organización Panamericana de la Salud estimó 16.000 casos nuevos de la enfermedad en 2017 (7) y el Instituto Nacional de Salud (INS) reportó una tasa de incidencia nacional de 17,7 casos por cada 100.000 habitantes en 2018 (8) y una tasa de mortalidad de 3 casos por 100 000 habitantes en 2017 (5).
La TB drogorresistente (TB-DR), resistente al menos a un medicamento antituberculoso, representa una crisis sanitaria global y una amenaza para el control de la TB (9,10). Dentro de este grupo, la TB resistente a rifampicina (TB-RR) y la TB multidrogorresistente (TB-MDR) —resistente a isoniazida y rifampicina— tienen una relevancia particular y suelen ser abordadas en conjunto (TB-MDR/RR), dado que con frecuencia su pronóstico y manejo son los mismos (3,11) y su importancia reside en al menos 3 hechos:
1) La rifampicina y la isoniazida son los dos medicamentos antituberculosos más potentes e importantes (12,13).
2) Una proporción considerable de la TB-DR es TB-MDR/RR (6), por ejemplo, el estudio de Garzón et al. (14), que evaluó la resistencia de TB en Colombia, encontró que 20% de los aislamientos de TB-DR en pacientes sin tratamiento previo presentaron TB-MDR/RR, porcentaje que ascendió a 71% en pacientes con tratamiento previo.
3) Los desenlaces son peores en presencia de resistencia (15,16): se estima que solo el 54% de los pacientes con TB-MDR/RR tiene un tratamiento exitoso, con deceso en el 16%, fallo en el tratamiento en el 8% y pérdida de seguimiento en el 21% (17).
Ante este panorama, el conocimiento de la epidemiología, los desenlaces, los mecanismos de resistencia y, principalmente, el manejo de la TB-MDR/RR se hace necesario para el personal de salud involucrado en la atención de estos pacientes y para los encargados de la creación de políticas para su control.
Epidemiología
En las últimas estimaciones de la Organización Mundial de la Salud (OMS) sobre la carga mundial de TB realizadas en 2018 (3) se encontraron cerca de 500.000 nuevos casos de TB-RR, de los cuales alrededor del 78% eran TB-MDR. La mitad de estos casos se originaron en India (27%), China (14%) y Rusia (9%); la región del sureste de Asia presentó el mayor número de nuevos casos de TB-MDR/RR (182.000), seguida por el Pacífico occidental (99.000). La tasa de incidencia más alta también perteneció al sureste asiático con 9,2 casos por cada 100.000 habitantes, seguida por Europa con 8,3 casos por cada 100.000 habitantes. En el mismo documento, la OMS también informó que a nivel mundial el 3,4% de los nuevos casos y el 18% de los casos previamente tratados correspondieron a TB-MDR/RR, porcentaje que fue considerablemente mayor en Europa: 18% para los casos nuevos y 54% para los previamente tratados. Para el continente americano la estimación fue de 11.000 nuevos casos, para una tasa de 1 por cada 100.000 habitantes (3).
El último estudio de vigilancia de resistencia de TB en Colombia se realizó en entre 2004 y 2005 (14); en este se evaluó la resistencia al tratamiento en 1.189 pacientes con TB y se encontró TB-MDR en el 2,4% de los casos no tratados y en el 31,4% de los tratados previamente. Posteriormente se describieron los hallazgos de todas las muestras procesadas por la Red Nacional de Laboratorios del INS en el año 2013 para pruebas de sensibilidad a fármacos (3.905 cultivos con reporte de resultados) (18) y, según estos datos, en ese año se encontraron 21 aislamientos de TB-RR monorresistente (0,5%) y 128 aislamientos de TB-MDR (3,3%). Por otro lado, en una publicación de 2017, el INS reportó 108 casos de TB-MDR y 42 casos de TB-RR para 2016 (19). Finalmente, de acuerdo con las estimaciones de la OMS, la incidencia de RR/TB-MDR en Colombia fue de 580 nuevos casos en 2018, lo que correspondió al 3,6% del total de nuevos casos de TB, con una tasa de 1,2 casos por cada 100.000 personas (3).
Desenlaces
Se estima que en 2018 se presentaron cerca de 214.000 muertes por TB-MDR/RR en todo el mundo, con una mayor frecuencia en hombres y en coinfección por VIH (3). La supervivencia y otros desenlaces son peores en presencia de resistencia bacteriana (15,16). Al respecto, el estudio de Mak et al. (15) reportó los desenlaces de 103 países que usaban la estrategia DOTS (Directly Observed Therapy, Short course), recomendada previamente por la OMS para el manejo de TB (20), y que contaban con estimaciones de la prevalencia de TB-MDR, y encontró una asociación significativa entre la prevalencia de TB-MDR y los desenlaces tras el manejo: en los países con prevalencia >3% se presentó fallo en el 5% y recaídas en el 12,8%, mientras que en prevalencia - 3% el fallo se presentó en el 1,6% y las recaídas en el 8,1%.
Mientras que el porcentaje de tratamiento exitoso de TB a nivel global según la OMS fue del 83%, 83% y 82% para los reportes anuales del 2016, 2017 y 2018, respectivamente, tales porcentajes fueron del 52%, 54% y 55% para los mismos años en el caso de TB-MDR/RR (3,17,21). Para el caso de Colombia, la estimación más reciente de la OMS indica un éxito en el manejo de TB-MDR/RR de 51% (3).
Mecanismos de resistencia
La resistencia a isoniazida está mediada hasta en el 90% de los casos por mutaciones en los genes katG y/o inhA (22,23). Este medicamento es una prodroga que debe ser captada por la bacteria y transformada por ella en ácido nicotínico (su forma activa) (24,25), conversión que es realizada por la enzima catalasa codificada por el gen katG, cuyas deleciones o mutaciones missense conferirían resistencia a este antibiótico (26-28). Respecto al gen inhA, este codifica la enzima enoil ACP reductasa, que está involucrada en la síntesis de ácido micólico, parte fundamental de la pared bacteriana de M. tuberculosis (24,29). Así, tras su activación por la catalasa, la forma activa de la izoniazida se uniría a la proteína codificada por inhA, impidiendo la formación adecuada de la pared bacteriana (30). De este modo, mutaciones que aumenten la actividad de este gen o que prevengan la unión de la isoniazida a su producto causarían resistencia al antibiótico (23). Otros mecanismos desconocidos y otros genes como ahpC, oxyR y fur estarían involucrados en una minoría de los casos de resistencia a este fármaco (23,24).
En cuanto a la rifampicina, es un medicamento que inhibe la ARN polimerasa bacteriana, enzima conformada por cuatro subunidades (31). La subunidad β de esta enzima participa en la iniciación y elongación de la síntesis del ARN mensajero (32). En más del 97% de los casos, la resistencia en Mycobacterium se da por mutaciones que incluyen deleciones, inserciones y sustituciones en el gen rpoB (24,33,34) que codifica esta subunidad (31).
Tratamiento
Acorde a las recomendaciones nacionales e internacionales, el manejo de TB-RR debe ser igual al de TB-MDR (11,35-37), por lo que en los siguientes párrafos solo se hará referencia a TB-MDR. Por otro lado, las últimas guías de manejo de TB-DR de la OMS fueron consolidadas en el 2019 (35) y acoplaron y actualizaron sus recomendaciones previas respecto a diferentes tópicos del manejo de TB (36,38-44), por lo que los siguientes párrafos plantean un manejo acorde a estas guías.
El tratamiento de la TB varía según las características del paciente, de su entorno y del aislamiento de la bacteria (13,35,45,46). En principio se cuenta con dos grupos de medicamentos: los de primera línea, usados en casos de TB sensible y compuestos por etambutol (E), pirazinamida (Z), isoniazida (H) y rifampicina (R), y los de segunda línea (MSL), que sustituyen a los primeros en caso de resistencia confirmada bacteriológicamente o sospechada clínica de toxicidad o de intolerancia. La OMS ha agrupado los MSL en 3 grupos para facilitar su implementación en el régimen largo individualizado de manejo (Tabla 1) (47).
Tabla 1. Agrupación de los fármacos recomendados para uso en el régimen largo individualizado para tuberculosis multidrogoresistente.
| Grupo | Medicamentos | Abreviación |
|---|---|---|
| Grupo A: Incluir los tres medicamentos | Levofloxacina o Moxifloxacina Bedaquilina2,3 Linezolid | Lfx o Mfx Bdq Lzd |
| Grupo B: Anadir ambos medicamentos | Clofazimina Cicloserina o Terizidona | Cfz Cs o Trd |
| Grupo C:1 Anadir para completar el régimen cuando los medicamentos de los grupos A y B no se puedan utilizar | Etambutol Delamanid3, 4. Pirazinamida. Imipenem-cilastatín o Meropenem5. Amikacina o Estreptomicina. Etionamida o Protionamida6. Ácido aminosalicílico6 | E Dlm Z Ipm-Cln o Mpm Am o S Eto o Pto PAS |
1 Los medicamentos del grupo C están organizados por orden decreciente de preferencia.
2 La evidencia sobre la seguridad y efectividad de la bedaquilina por más de 6 meses y en menores de 6 años es insuficiente y su uso en estos casos se considera "off-label".
3 La evidencia del uso concomitante de bedaquilina y delamanid es insuficiente.
4 La evidencia sobre la seguridad y efectividad del delamanid por más de 6 meses y en menores de 3 años es insuficiente y su uso en estos casos se considera "off-label".
5 Cada dosis de Imipenem-cilastatín o Meropenem debe administrarse conjuntamente con clavulonato, que solo está disponible acompañado de amoxicilina.
6 Estos medicamentos mostraron efectividad solo en regímenes sin bedaquilina, linezolid, clofazimina o delamanid y, por lo tanto, solo se proponen cuando otras opciones no son posibles.
Fuente: Elaboración con base en (47).
Según esta clasificación de la OMS, existen dos regímenes posibles para MDR/TB:
Régimen corto estandarizado: Inicia con una fase intensiva de 4 meses de gatifloxacina (o moxifloxacina), kanamicina (o amikacina), protionamida, clofazimina, isoniazida a altas dosis (15-20mg/kg/día), pirazinamida y etambutol que se prolonga a 6 meses para pacientes con baciloscopia y con cultivo positivo 2 meses después del inicio del manejo. Posteriormente se administra una fase de continuación de 5 meses de etambutol, pirazinamida, moxifloxacina y clofazimina (36,48).
Régimen largo individualizado: Se administran al menos cuatro medicamentos: los tres del grupo A y al menos uno del grupo B. Si solo se puede administrar uno o dos del grupo A, se deben administrar los dos del grupo B. Si no se pueden completar cuatro medicamentos con el grupo A y B, se debe hacer con el grupo C. Los medicamentos se administran en una fase intensiva que se extiende 6 meses tras la conversión de cultivo de esputo (realizada dos meses tras el inicio del manejo). La Bedaquilina (Bdq) y la Delamanid (Dlm) deben administrarse por máximo 6 meses (49,50); tiempo adicional se considera “off-label” (51). En caso de no disponibilidad de Bdq, se debe administrar amikacina (Am) o estreptomicina (S) y la fase intensiva debe ser de 6-7 meses. Posteriormente, se administra una fase de continuación de 15-17 meses contados desde el momento de la conversión de cultivo de esputo, continuando todos los medicamentos de la fase intensiva a excepción de Bdq, Am y S. La duración de ambas fases puede ser modificada según la respuesta del paciente (35).
El régimen corto puede considerarse en pacientes que no han recibido manejo previo por más de 1 mes con MSL; en quienes la resistencia a las fluoroquinolonas y a los MSL inyectables ha sido excluida, y en quienes no se presenta gestación, TB extrapulmonar en coinfección con VIH o TB diseminada, meníngea o en sistema nervioso central (35,44). En todos los demás casos debe administrarse el régimen largo. En caso de intolerancia al régimen corto, riesgo de toxicidad, fallo en el manejo o preferencias del paciente y/o del clínico, debe priorizarse el régimen largo (Figura 1).
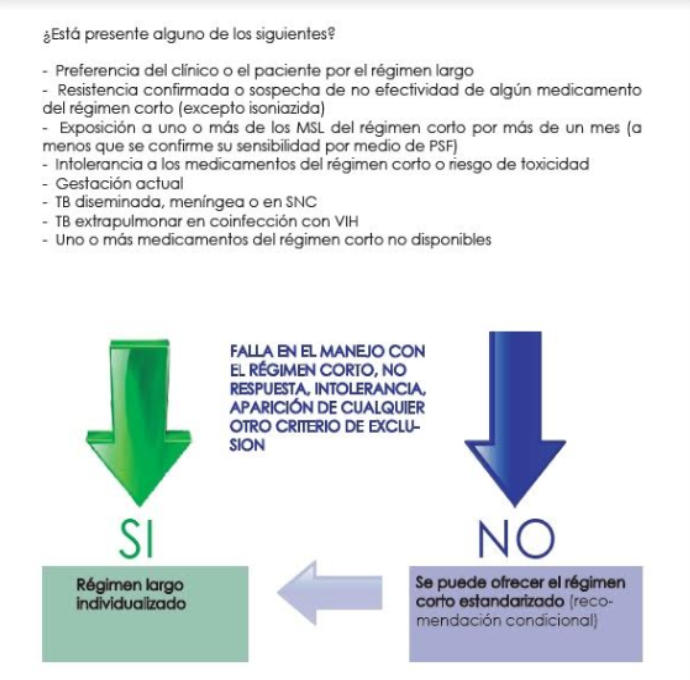
Figura 1. Criterios para seleccionar el régimen corto estandarizado en tuberculosis multidrogoresistente.
MSL: medicamentos de segunda línea; PSF: pruebas de sensibilidad a fármacos; TB: tuberculosis; SNC: sistema nervioso central; VIH: virus de la inmunodeficiencia humana.
Fuente: Elaboración con base en (35).
La evidencia para el uso del régimen corto proviene de algunos datos observacionales que llevaron a considerarlo como una opción útil (52-54). Por ejemplo, un metaanálisis de 5 estudios observacionales publicado en 2017 en el que se incluyeron 796 pacientes con TB-MDR/RR encontró un tratamiento exitoso en el 83% de los casos (55). A raíz de este tipo de datos se realizó el estudio STREAM (48), un ensayo clínico aleatorizado realizado en África y Asia que comparó ambos regímenes en pacientes con TB-MDR/RR; el estudio incluyó 383 participantes, un tercio de los cuales presentaba coinfección con VIH, y encontró no inferioridad del régimen corto. Además, como parte del análisis preliminar del estudio STREAM, el régimen corto llevó a una disminución del 34% en el gasto de tratamiento de TB-MDR por parte del sistema de salud de Etiopía y del 46% en Sudáfrica (56,57).
Respecto al régimen largo, todas las fuentes reconocen que la elección ideal de medicamentos, su combinación y duración en TB-MDR no ha sido claramente establecida, existiendo un fundamento epidemiológico poco sólido al respecto (13,46,58). En 2019, la OMS reconoció que la evidencia de los medicamentos proviene principalmente de estudios observacionales y, por lo tanto, la mayoría de sus recomendaciones tiene una certeza baja o muy baja (35). En este contexto, a principios de 2018 esta misma institución hizo un llamado público para obtener datos de pacientes individuales (IPD) con TB-MDR/RR (59), los cuales permiten realizar estudios de la composición de los regímenes (60-62). A partir de esta información se realizó un metaanálisis de IPD con 13.104 registros de 53 estudios en 40 países en el que además se tuvo en cuenta información publicada por von Groote-Bidlingmaier et al. (63), así como de algunos otros estudios en proceso de publicación.
De esta manera, la OMS expuso en sus guías más recientes los OR estimados para cada uno de los medicamentos para el desenlace falla en el tratamiento o recaída y para el desenlace muerte, lo que va de la mano de sus recomendaciones para la elección de medicamentos en el régimen largo individualizado (Tabla 2) (35). Como se ve, la OMS priorizó Bdq, linezolid (Lzd) y levofloxacina (Lfx) o moxifloxacina (Mfx), incluidos en el grupo A, de forma consecuente a los mejores desenlaces con su uso según sus estimaciones. Así mismo, la Bdq mostró alta efectividad en varios estudios observacionales (64-66), así como mayor y más rápida negativización del cultivo de esputo al compararse con placebo en tres ensayos clínicos de fase 2 (67-69). Del mismo modo, la Lzd mostró alguna evidencia de eficacia en cuanto a curación y a conversión del esputo en dos ensayos clínicos aleatorizados incluidos en una revisión Cochrane reciente (70). Finalmente, la inclusión de las fluoroquinolonas se asoció a mejores desenlaces en dos metaanálisis (60,61), habiéndose encontrado previamente una proporción similar de conversión del cultivo de esputo con el uso de Lfx y Mfx (71).
Tabla 2. OR para falla en el tratamiento o recaída y muerte según estimaciones de la Organización Mundial de la Salud.
| Medicamento | Falla terapéutica o recaída | Muerte | |||
| Pacientes tratados | OR ajustado (Intervalos de confianza 95%)) | Pacientes tratados | OR ajustado (Intervalos de confianza 95%) | ||
| A | Levofloxacina O Moxilofloxacina | 3.143 | 0,1 (0,1-0,5) | 3.551 | 0,2 (0,1-0,3) |
| Bedaquilina | 1.391 | 0,3 (0,2-0,4) | 1.480 | 0,2 (0,2-0,3) | |
| Linezolid | 1.216 | 0,3 (0,2-0,5) | 1.286 | 0,3 (0,2-0,3) | |
| B | Clofazimina | 991 | 0,3 (0,2-0,5) | 1.096 | 0,4 (0,3-0,6) |
| Cicloserina O terizidona | 5.483 | 0,6 (0,4-0,9) | 6.160 | 0,6 (0,5-0,8) | |
| C | Etambutol | 1.163 | 0,4 (0,1-1,0) | 1.245 | 0,5 (0,1-1,7) |
| Delamanid | 289 | 1,1 (0,4-2,8) | 290 | 1,2 (0,5-3,0) | |
| Pirazinamida | 1.248 | 2,7 (0,7-10,9) | 1.272 | 1,2 (0,1-15,7) | |
| Imipenem-cilastatín O menopenem | 206 | 0,4 (0,2-0,7) | 204 | 0,2 (0,1-0,5) | |
| Amikacina | 635 | 0,3 (0,1-0,8) | 727 | 0,7 (0,4-1,2) | |
| Estreptomicina | 226 | 0,5 (0,1-2,1) | 238 | 0,1 (0,0-0,4) | |
| Etionamida O protionamida | 2.582 | 1,6 (0,5-5,5) | 2.750 | 2,0 (0,8-5,3) | |
| Ácido aminosalicílico | 1.564 | 3,1 (1,1-8,9) | 1.609 | 1,0 (0,6-1,6) | |
| Otros | Kanamicina | 2.946 | 1,9 (1,0-3,4) | 3.269 | 1,1 (0,5-2,1) |
| Capreomicina | 777 | 2,0 (1,1-3,5) | 826 | 1,4 (0,7-2,8) | |
| Amoxicilina-clavulonato | 492 | 1,7 (1,0-3,0) | 534 | 2,2 (1,3-3,6) | |
Fuente: Elaboración con base en (35).
El Ministerio de Salud y Protección Social de Colombia publicó recientemente los Lineamientos Técnicos y Operativos del Programa Nacional de Tuberculosis (37), los cuales tuvieron en cuenta las guías de la OMS. Este documento estableció un esquema largo compuesto por una fase intensiva de 6 meses de Lfx-Lzd-Bdq-Cfz y una etapa de continuación de 12-14 meses de Lfx-Lzd-Cfz, reemplazando Bdq por Cs en caso de menores de 6 años. En cuanto al régimen corto, estableció 4-6 meses de Am-Mfx-Eto-Cfz-Z-H altas dosis-E, seguidos por 5 meses de Mfx-Cfz-Z-E. Las dosis de los MSL establecidas en este documento se muestran en la Tabla 3. Es necesario aclarar que esta información se considera preliminar hasta que se cuente con la resolución oficial.
Tabla 3. Dosis diarias establecidas para los medicamentos de segunda línea en el tratamiento de tuberculosis multidrogoresistente en Colombia.
| Medicamento | Grupo de peso | ||
| Menos de 30Kg | De 30 a 50 Kg | Mayor a 50Kg | |
| Moxifloxacina | 400 mg | 600 mg | 800 mg |
| Bedaquilina | 400 mg diarios por las primeras 2 semanas luego 200 mg tres veces por semana hasta las 22 semanas | ||
| Linezolid | 600 mg | ||
| Clofazimina | 50 mg | 100 mg | 100 mg |
| Cicloserina | 500 mg | 500 mg | 750 mg |
| Etambutol | 800 mg | 800 mg | 1200 mg |
| Delamanid | 100 mg | ||
| Pirazinamida | 1000 mg | 1400 mg | 2000 |
| Isoniazida en altas dosis | 300 mg | 400 mg | 600 mg |
| Etionamida | 250 mg | 500 mg | 750 mg |
| Amikacina | 15 -20 mg por kilogramo de peso (máximo 1g) | ||
Fuente: Tomado de (37).
Conclusiones
La TB-MDR presenta una alta prevalencia mundial, con gran variación en diferentes regiones y con peores desenlaces en quienes padecen esta variedad que en los afectados por cepas sensibles, presentando los primeros una mayor mortalidad y falla terapéutica. Su resistencia está mediada principalmente por mutaciones en los genes KatG y/o inhA para el caso de la izoniazida, y por mutaciones en el gen rpoB para el caso de la rifampicina.
Recientemente se actualizaron las guías de manejo de la OMS con varios cambios respecto a indicaciones previas; allí se resalta la reagrupación de los MSL de acuerdo a la nueva evidencia sobre su efectividad, la priorización de los medicamentos orales sobre los inyectables y el mayor campo para el uso del régimen corto estandarizado, aunque se reconoce la débil evidencia disponible para la mayoría de sus recomendaciones. Teniendo en cuenta estas guías, Colombia publicó sus lineamientos de manejo de TB, indicando un esquema corto de 4-6 meses de Am-Mfx-Eto-Cfz-Z-H altas dosis-E, seguidos por 5 meses de Mfx-Cfz-Z-E, y un esquema largo de 6 meses de Lfx-Lzd-Bdq-Cfz seguido de 12-14 meses de Lfx-Lzd-Cfz.
References
- 1. Murray PR, Rosenthal KS, Pfaller MA. Mycobacterium. En: Microbiología médica. 6ta ed. Barcelona: Elsevier España; 2009.
- 2. Kumar V, Abbas AK, Fausto N, Aster JC. Micobacterias. En: Robbins y Cotran: Patología estructural y funcional. 8va ed. Barcelona: Elsevier España; 2010.
- 3. World Health Organization (WHO). Global tuberculosis report 2019. Geneva: WHO; 2019.
- 4. Raviglione MC. Tuberculosis. En: Jameson JL, Fauci AS, Kasper DL, Hauser SL, Longo DL, Loscalzo J, editores. Harrison: Principios de medicina interna. 18va ed. New York: McGraw-Hill; 2012.
- 5. Colombia. Instituto Nacional de Salud (INS). Informe de evento: Tuberculosis, Colombia, 2017. Bogotá, D.C.: INS; 2018.
- 6. Houben RM, Dodd PJ. The Global Burden of Latent Tuberculosis Infection: A Re-estimation Using Mathematical Modelling. PLoS Med. 2016;13(10):e1002152. DOI: 10.1371/journal.pmed.1002152.
- 7. Organización Panamericana de la Salud (OPS). Tuberculosis en las Américas 2018. Washington, D.C.: OPS; 2018.
- 8. Colombia. Instituto Nacional de Salud (INS). Boletín Epidemiológico Semanal. Semana epidemiológica 38. Bogotá D.C.: INS; 2018.
- 9. Gandhi NR, Nunn P, Dheda K, Schaaf HS, Zignol M, van Soolingen D, et al. Multidrug-resistant and extensively drug-resistant tuberculosis: a threat to global control of tuberculosis. Lancet. 2010;375(9728):1830-43. DOI: 10.1016/S0140-6736(10)60410-2.
- 10. Daley CL, Caminero JA. Management of Multidrug-Resistant Tuberculosis. Semin Respir Crit Care Med. 2018;39(3):310-24. DOI: 10.1055/s-0038-1661383.
- 11. Colombia. Ministerio de Salud y Protección Social (MinSalud). Circular externa 55 de 2016 (diciembre 20): Actualización DE los lineamientos para el manejo programático de tuberculosis en niños, casos farmacoresistentes y aspectos de la programación de sintomáticos respiratorios. Bogota D.C.: MinSalud; 2016.
- 12. Centers for Disease Control and Prevention (CDC). Core Curriculum on Tuberculosis: What the Clinician Should Know. 6ta ed. CDC; 2013.
- 13. Colombia. Ministerio de Salud y Protección Social, Instituto Nacional de Salud. Lineamientos para el manejo programático de pacientes con tuberculosis farmacorresistente. Bogotá D.C.: MinSalud; 2013.
- 14. Garzón MC, Angée DY, Llerena C, Orjuela DL, Victoria JE. Vigilancia de la resistencia del Mycobacterium tuberculosis a los fármacos antituberculosos, Colombia 2004-2005. Biomédica. 2008:28(3):319-26. DOI: 10.7705/biomedica.v28i3.71.
- 15. Mak A, Thomas A, Del Granado M, Zaleskis R, Mouzafarova N, Menzies D. Influence of multidrug resistance on tuberculosis treatment outcomes with standardized regimens. Am J Respir Crit Care Med. 2008;178(3):306-12. DOI: 10.1164/rccm.200802-240OC.
- 16. Lew W, Pai M, Oxlade O, Martin D, Menzies D. Initial drug resistance and tuberculosis treatment outcomes: systematic review and meta-analysis. Ann Intern Med. 2008;149(2):123-34. DOI: 10.7326/0003-4819-149-2-200807150-00008.
- 17. World Health Organization (WHO). Global tuberculosis report 2017. Geneva: WHO; 2017.
- 18. Colombia. Instituto Nacional de Salud (INS). Informe de actividades realizadas por la Red Nacional de Laboratorios para la vigilancia de la resistencia de Mycobacterium tuberculosis a los fármacos Antituberculosos, Colombia 2013. Bogotá D.C.: INS; 2014.
- 19. Colombia. Instituto Nacional de Salud (INS). Protocolo de vigilancia en salud pública: Tuberculosis farmacoresistente. Bogotá, D.C.: INS; 2017.
- 20. World Health Organization (WHO). Treatment of tuberculosis: guidelines for national programmes. Geneva: WHO; 2003. WHO.
- 21. World Health Organization (WHO). Global tuberculosis report 2016. Geneva: WHO; 2016.
- 22. Centers for Disease Control and Prevention (CDC). Laboratory User Guide for U.S. Public Health Laboratories: Molecular Detection of Drug Resistance (MDDR) in Mycobacterium tuberculosis Complex by DNA Sequencing (Version 2.0), June 2012. Atlanta: CDC; 2012 [citado 2019 sep 14]. Disponible en: https://www.cdc.gov/tb/topic/laboratory/mddrusersguide.pdf.
- 23. Telenti A. Genetics and pulmonary medicine. 5. Genetics of drug resistant tuberculosis. Thorax. 1998;53(9):793-7. DOI: 10.1136/thx.53.9.793.
- 24. Fontalvo-Rivera D, Gómez-Camargo D. Genes del Mycobacterium tuberculosis involucrados en la patogenicidad y resistencia a antibióticos durante la tuberculosis pulmonar y extrapulmonar. Medicas UIS. 2015;28(1):39-51.
- 25. Sacchettini JC, Blanchard JS. The structure and function of the isoniazid target in M. tuberculosis. Res Microbiol. 1996;147(1-2):36-43. DOI: 10.1016/0923-2508(96)80201-4.
- 26. Zhang Y, Heym B, Allen B, Young D, Cole S. The catalase-peroxidase gene and isoniazid resistance of Mycobacterium tuberculosis. Nature. 1992;358(6387):591-3. DOI: 10.1038/358591a0.
- 27. Heym B, Alzari PM, Honoré N, Cole ST. Missense mutations in the catalase-peroxidase gene, katG, are associated with isoniazid resistance in Mycobacterium tuberculosis. Mol Microbiol. 1995;15(2):235-45. DOI: 10.1111/j.1365-2958.1995.tb02238.x.
- 28. Cockerill FR, Uhl JR, Temesgen Z, Zhang Y, Stockman L, Roberts GD, et al. Rapid identification of a point mutation of the Mycobacterium tuberculosis catalase-peroxidase (katG) gene associated with isoniazid resistance. J Infect Dis. 1995;171(1):240-5. DOI: 10.1093/infdis/171.1.240.
- 29. Brennan PJ, Nikaido H. The envelope of mycobacteria. Annu Rev Biochem. 1995;64:29-63. DOI: 10.1146/annurev.bi.64.070195.000333.
- 30. Rozwarski DA, Grant GA, Barton DH, Jacobs WR, Sacchettini JC. Modification of the NADH of the isoniazid target (InhA) from Mycobacterium tuberculosis. Science. 1998;279(5347):98-102. DOI: 10.1126/science.279.5347.98.
- 31. Bloom BR. Tuberculosis: Pathogenesis, Protection, and Control. Washington DC: ASM Press; 1994.
- 32. Miller LP, Crawford JT, Shinnick TM. The rpoB gene of Mycobacterium tuberculosis. Antimicrob Agents Chemother. 1994;38(4):805-11. DOI: 10.1128/aac.38.4.805.
- 33. Telenti A, Imboden P, Marchesi F, Lowrie D, Cole S, Colston MJ, et al. Detection of rifampicin-resistance mutations in Mycobacterium tuberculosis. Lancet. 1993;341(8846):647-50. DOI: 10.1016/0140-6736(93)90417-f.
- 34. Cole ST. Rifamycin resistance in mycobacteria. Res Microbiol. 1996;147(1-2):48-52. DOI: 10.1016/0923-2508(96)80203-8.
- 35. World Health Organization (WHO). Consolidated guidelines on drug-resistant tuberculosis treatment. Geneva: WHO; 2019.
- 36. World Health Organization (WHO). WHO Treatment Guidelines for Drug-Resistant Tuberculosis: 2016 Update. Geneva: WHO; 2016.
- 37. Colombia. Ministerio de Salud y Protección Social. Lineamientos técnicos y operativos del programa nacional de tuberculosis [documento en consulta interna]. Bogotá: MinSalud; 2019.
- 38. World Health Organization (WHO). Guidelines for the programmatic management of drug-resistant tuberculosis: 2011 update. Geneva: WHO; 2011.
- 39. World Health Organization (WHO). The Use of bedaquiline in the Treatment of MultidrugResistant Tuberculosis: Interim Policy Guidance. Geneva: WHO; 2013.
- 40. World Health Organization (WHO). The Use of delamanid in the Treatment of MultidrugResistant Tuberculosis: Interim Policy Guidance. Geneva: WHO; 2014.
- 41. World Health Organization (WHO). The use of delamanid in the treatment of multidrug-resistant tuberculosis in children and adolescents: interim policy guidance. Geneva: WHO; 2016.
- 42. World Health Organization (WHO). Guidelines for the treatment of drug-susceptible tuberculosis and patient care: 2017 update. Geneva: WHO; 2017.
- 43. World Health Organization (WHO). WHO treatment guidelines for isoniazid-resistant tuberculosis. Supplement to the WHO treatment guidelines for drug-resistant tuberculosis. Geneva: WHO; 2018.
- 44. World Health Organization. WHO treatment guidelines for multidrug- and rifampicin-resistant tuberculosis: 2018 update. Geneva: WHO; 2018.
- 45. Nahid P, Dorman SE, Alipanah N, Barry PM, Brozek JL, Cattamanchi A, et al. Official American Thoracic Society/Centers for Disease Control and Prevention/Infectious Diseases Society of America Clinical Practice Guidelines: Treatment of Drug-Susceptible Tuberculosis. Clin Infect Dis. 2016;63(7):e147-e95. DOI: 10.1093/cid/ciw376.
- 46. Curry International Tuberculosis Center. Drug-Resistant Tuberculosis: A Survival Guide for Clinicians. 3ra ed. Washington D.C.; CITC; 2016.
- 47. World Health Organization (WHO). Rapid communication: key changes to treatment of multidrug- and rifampicin-resistant tuberculosis (TB-MDR/RR). Geneva: WHO; 2019 [citado 2019 sep 20]. Disponible en: https://www.who.int/tb/publications/2019/WHO_RapidCommunicationMDRTB2019.pdf?ua=1.
- 48. Nunn AJ, Phillips PPJ, Meredith SK, Chiang CY, Conradie F, Dalai D, et al. A Trial of a Shorter Regimen for Rifampin-Resistant Tuberculosis. N Engl J Med. 2019;380(13):1201-13. DOI: 10.1056/NEJMoa1811867.
- 49. Deltyba (delamanid). Amsterdam: European Medicines Agency; 2018 [citado 2019 sep 27]. Disponible en: https://www.ema.europa.eu/en/medicines/human/EPAR/deltyba.
- 50. Sirturo (bedaquiline). Amsterdam: European Medicines Agency; 2014. [citado 2019 sep 27]. Disponible en: https://www.ema.europa.eu/en/medicines/human/EPAR/sirturo.
- 51. World Health Organization (WHO). WHO best-practice statement on the off-label use of bedaquiline and delamanid for the treatment of multidrug-resistant tuberculosis. Geneva: WHO; 2017 [citado 2019 sep 27]. Disponible en: http://apps.who.int/iris/bitstream/10665/258941/1/WHO-HTM-TB-2017.20-eng.pdf.
- 52. Van Deun A, Maug AKJ, Salim MAH, Das PK, Sarker MR, Daru P, et al. Short, highly effective, and inexpensive standardized treatment of multidrug-resistant tuberculosis. Am J Respir Crit Care Med. 2010;182(5):684-92. DOI: 10.1164/rccm.201001-0077OC.
- 53. Kuaban C, Noeske J, Rieder HL, Aït-Khaled N, Abena Foe JL, Trébucq A. High effectiveness of a 12-month regimen for TB-MDR patients in Cameroon. Int J Tuberc Lung Dis. 2015;19(5):517-24. DOI: 10.5588/ijtld.14.0535.
- 54. Piubello A, Harouna SH, Souleymane MB, Boukary I, Morou S, Daouda M, et al. High cure rate with standardised short-course multidrug-resistant tuberculosis treatment in Niger: no relapses. Int J Tuberc Lung Dis. 2014;18(10):1188-94. DOI: 10.5588/ijtld.13.0075.
- 55. Ahmad-Khan F, Salim MAH, du Cros P, Casas EC, Khamraev A, Sikhondze W, et al. Effectiveness and safety of standardised shorter regimens for multidrug-resistant tuberculosis: individual patient data and aggregate data meta-analyses. Eur Respir J. 2017;50(1):1700061. DOI: 10.1183/13993003.00061-2017..
- 56. World Health Organization (WHO). Position Statement on the Continued Use of the Shorter TB-MDR Regimen following an Expedited Review of the STREAM Stage 1 Preliminary Results. Geneva: WHO; 2018.
- 57. Moodley R, Godec TR, Team ST. Short-course treatment for multidrug-resistant tuberculosis: the STREAM trials. Eur Respir Rev. 2016;25(139):29-35. : 10.1183/16000617.0080-2015.
- 58. Caminero JA, Caylac JA, García-García JM, García-Pérez FJ, Palacios JJ, Ruiz-Manzano J. Diagnóstico y tratamiento de la tuberculosis con resistencia a fármacos. Arch Bronconeumol. 2017;53(9):501-9. DOI: 10.1016/j.arbres.2017.02.006.
- 59. World Health Organization (WHO). Public call for individual patient data on treatment of rifampicin and multidrugresistant (TB-MDR/RR) tuberculosis. Geneve: WHO; 2018 [citado 2019 sep 22]. Disponible en: http://www.who.int/tb/features_archive/public_call_treatment_RR_MDR_TB/en/.
- 60. Ahuja SD, Ashkin D, Avendano M, Banerjee R, Bauer M, Bayona JN, et al. Multidrug resistant pulmonary tuberculosis treatment regimens and patient outcomes: an individual patient data meta-analysis of 9,153 patients. PLoS Med. 2012;9(8):e1001300. DOI: 10.1371/journal.pmed.1001300.
- 61. Ahmad N, Ahuja SD, Akkerman OW, Alffenaar JC, Anderson LF, Baghaei P, et al. Treatment correlates of successful outcomes in pulmonary multidrug-resistant tuberculosis: an individual patient data meta-analysis. Lancet. 2018;392(10150):821-34. DOI: 10.1016/S0140-6736(18)31644-1.
- 62. Harausz EP, Garcia-Prats AJ, Law S, Schaaf HS, Kredo T, Seddon JA, et al. Treatment and outcomes in children with multidrug-resistant tuberculosis: A systematic review and individual patient data meta-analysis. PLoS Med. 2018;15(7):e1002591. DOI: 10.1371/journal.pmed.1002591.
- 63. von Groote-Bidlingmaier F, Patientia R, Sanchez E, Balanag V, Ticona E, Segura P, et al. Efficacy and safety of delamanid in combination with an optimised background regimen for treatment of multidrug-resistant tuberculosis: a multicentre, randomised, double-blind, placebo-controlled, parallel group phase 3 trial. Lancet Respir Med. 2019;7(3):249-59. DOI: 10.1016/S2213-2600(18)30426-0.
- 64. Zhao Y, Fox T, Manning K, Stewart A, Tiffin N, Khomo N, et al. Improved treatment outcomes with bedaquiline when substituted for second-line injectable agents in multidrug resistant tuberculosis: a retrospective cohort study. Clin Infect Dis. 2018 ;68(9):1522-1529. DOI: 10.1093/cid/ciy727.
- 65. Borisov SE, Dheda K, Enwerem M, Romero-Leyet R, D'Ambrosio L, Centis R, et al. Effectiveness and safety of bedaquiline-containing regimens in the treatment of MDR- and XTB-DR: a multicentre study. Eur Respir J. 2017;49(5):1700387. DOI: 10.1183/13993003.00387-2017.
- 66. Schnippel K, Ndjeka N, Maartens G, Meintjes G, Master I, Ismail N, et al. Effect of bedaquiline on mortality in South African patients with drug-resistant tuberculosis: a retrospective cohort study. Lancet Respir Med. 2018;6(9):699-706. DOI: 10.1016/S2213-2600(18)30235-2.
- 67. Diacon AH, Pym A, Grobusch MP, de los Rios JM, Gotuzzo E, Vasilyeva I, et al. Multidrug-resistant tuberculosis and culture conversion with bedaquiline. N Engl J Med. 2014;371(8):723-32. DOI: 10.1056/NEJMoa1313865.
- 68. Diacon AH, Pym A, Grobusch M, Patientia R, Rustomjee R, Page-Shipp L, et al. The diarylquinoline TMC207 for multidrug-resistant tuberculosis. N Engl J Med. 2009;360(23):2397-405. DOI: 10.1056/NEJMoa0808427.
- 69. Diacon AH, Donald PR, Pym A, Grobusch M, Patientia RF, Mahanyele R, et al. Randomized pilot trial of eight weeks of bedaquiline (TMC207) treatment for multidrug-resistant tuberculosis: long-term outcome, tolerability, and effect on emergence of drug resistance. Antimicrob Agents Chemother. 2012;56(6):3271-6. DOI: 10.1128/AAC.06126-11.
- 70. Singh B, Cocker D, Ryan H, Sloan DJ. Linezolid for drug-resistant pulmonary tuberculosis. Cochrane Database Syst Rev. 2019;3(3):CD012836. DOI: 10.1002/14651858.CD012836.pub2.
- 71. Koh WJ, Lee SH, Kang YA, Lee CH, Choi JC, Lee JH, et al. Comparison of levofloxacin versus moxifloxacin for multidrug-resistant tuberculosis. Am J Respir Crit Care Med. 2013;188(7):858-64. DOI: 10.1164/rccm.201303-0604OC.